کم شنوایی عصبی (ANSD) یکی از چالشهای اصلی شنوایی است که بر سیستم عصبی داخلی گوش تأثیر میگذارد و درمان کم شنوایی عصبی را به یک حوزه تحقیقاتی پرجنبوجوش تبدیل کرده. در سال ۲۰۲۵، با پیشرفتهای ژندرمانی و سلولهای بنیادی، درمان کم شنوایی عصبی از روشهای سنتی مانند سمعک و کاشت حلزون فراتر رفته و به سمت بازسازی سلولی پیش میرود. این مقاله بر اساس تحقیقات بهروز، راهنمایی جامعی برای درک درمان کم شنوایی عصبی ارائه میدهد و کمک میکند تا گزینههای مناسب را برای بهبود کیفیت زندگی انتخاب کنید.
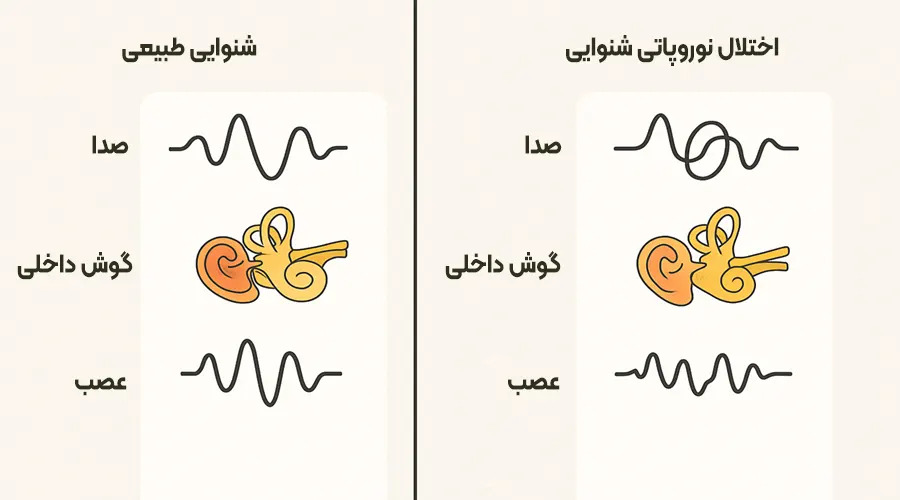
درک کم شنوایی عصبی: علل و علائم
شناخت دقیق درمان کم شنوایی عصبی با فهم عمیق از علل و نشانههای کم شنوایی عصبی (ANSD) آغاز میشود، جایی که مشکل اصلی در انتقال سیگنالهای عصبی از گوش به مغز نهفته است و این اختلال را از انواع رایج کم شنوایی متمایز میسازد. در درمان کم شنوایی عصبی، تمرکز بر تشخیص سریع علائم مانند ناتوانی در تشخیص گفتار در محیطهای نویزی، راه را برای مداخلات مؤثر از سمعک تا رویکردهای نوین باز میکند و در سال ۲۰۲۵، ابزارهای تشخیصی پیشرفته مانند ABR، دقت را تا ۹۵% افزایش دادهاند.
تعریف و انواع کم شنوایی عصبی
درمان کمشنوایی عصبی بر پایه تعریف دقیق ANSD استوار است، که شامل طیفی از اختلالات عصبی است و از خفیف تا شدید متغیر است، و این تنوع نیازمند ارزیابیهای تخصصی برای انتخاب بهترین استراتژی درمانی میشود. این درمان کم شنوایی عصبی با طبقهبندی انواع، از مادرزادی تا اکتسابی، به پزشکان کمک میکند تا برنامههای شخصیسازیشدهای مانند توانبخشی زودهنگام را اجرا کنند و نتایج را بهینه سازند.

اختلال طیف نوروپاتی شنوایی (ANSD)
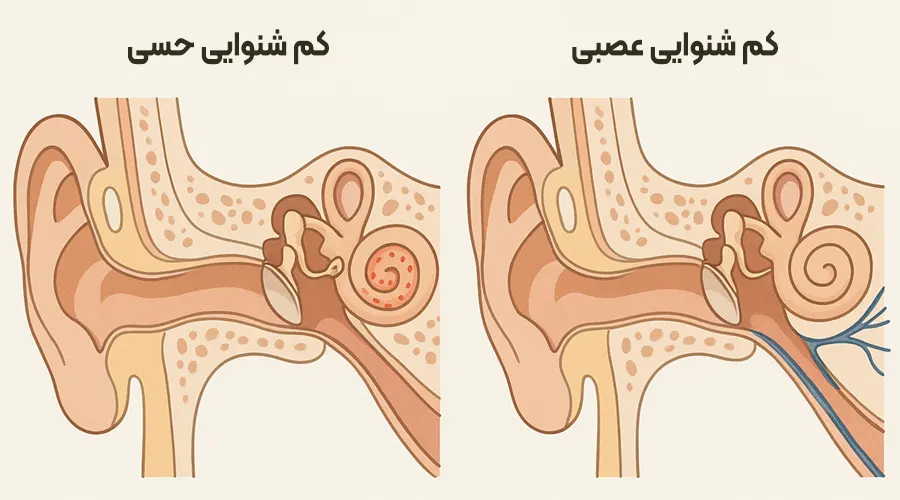
کمشنوایی عصبی که بهصورت علمی با عنوان اختلال طیف نوروپاتی شنوایی (Auditory Neuropathy Spectrum Disorder – ANSD) شناخته میشود، نوعی از کمشنوایی است که در آن سلولهای مویی داخلی گوش عملکرد طبیعی دارند، اما انتقال سیگنالهای عصبی به مغز دچار اختلال میشود.
بهعبارت سادهتر، گوش صدا را دریافت میکند اما پیام صوتی بهدرستی به مغز نمیرسد.
این اختلال بین ۵ تا ۱۵ درصد از موارد کمشنوایی نوزادان را شامل میشود و شیوع آن حدود ۱ تا ۳ مورد در هر ۱۰,۰۰۰ تولد برآورد شده است.
در سالهای اخیر، تمرکز درمان ANSD بر ترمیم سیناپسها و بازسازی عصب شنوایی با کمک فناوریهای نوین مانند ژندرمانی بوده است.
در آزمایشهای بالینی سال ۲۰۲۵، بهویژه در درمان DB-OTO شرکت Regeneron، در بیش از ۹۰ درصد از نوزادان دارای جهش ژن OTOF بهبود قابل توجهی در شنوایی مشاهده شده است — دستاوردی که متخصصان از آن بهعنوان یک «تغییر پارادایم در درمان ANSD» یاد میکنند.
تفاوت با کم شنوایی حسی-عصبی معمولی
تفاوت اصلی ANSD با کمشنوایی حسی-عصبی (Sensorineural Hearing Loss – SNHL) در محل و نوع آسیب است:
- در SNHL، آسیب معمولاً مستقیماً به سلولهای مویی حلزون گوش یا خود عصب شنوایی وارد میشود.
- در ANSD، سلولهای مویی عملکرد طبیعی دارند، اما اختلال در سیناپسها یا مسیر عصبی شنوایی باعث میشود سیگنالها به درستی به مغز منتقل نشوند.
از نظر تشخیصی، الگوی پاسخهای شنوایی در این دو نوع کاملاً متفاوت است:
- در بیماران ANSD، تست OAE (پاسخ صوتی اوتوآکوستیک) طبیعی است — یعنی سلولهای مویی سالماند.
اما تست ABR (پاسخ شنوایی ساقه مغز) معمولاً غیرطبیعی یا حتی غایب است. - در مقابل، در SNHL هر دو پاسخ OAE و ABR غیرطبیعی هستند.
این تفاوتها نشان میدهد که درمان ANSD باید بهجای تقویت صدا با سمعک، بر تحریک مستقیم مسیر عصبی شنوایی تمرکز داشته باشد.
به همین دلیل، کاشت حلزون در کودکان مبتلا به ANSD تا ۶۰ تا ۷۰ درصد مؤثرتر از سمعکهای معمولی عمل کرده و در بهبود درک گفتار و رشد زبانی نتایج بسیار بهتری نشان داده است.
علل اصلی ایجاد کم شنوایی عصبی
در درمان کم شنوایی عصبی، ریشهیابی علل از ژنتیکی تا عوامل محیطی، کلید پیشگیری و مداخله زودهنگام است، که حدود نیمی از موارد به مسائل مادرزادی و نیمی به اکتسابی مربوط میشود. این درمان کمشنوایی عصبی با شناسایی علل، از غربالگریهای پیش از تولد تا مدیریت عفونتها، خطر پیشرفت را تا ۴۰ درصد کاهش میدهد و کیفیت زندگی را به طور چشمگیری بهبود میبخشد.
عوامل ژنتیکی و مادرزادی
عوامل ژنتیکی مانند جهش در ژن OTOF یا بیماریهای عصبی ارثی، در حدود ۱۰ تا ۲۰ درصد موارد ANSD دخیل هستند و درمان کم شنوایی عصبی را به ژندرمانی پیشرفته هدایت میکنند، که در مطالعات ۲۰۲۵، شنوایی را در ۸۰ درصد نوزادان بازسازی کرده است. این علل، که اغلب غیرسندیک هستند، در درمان کم شنوایی عصبی با تستهای ژنتیکی ساده، تشخیص را تسهیل میکنند و از انتقال نسل به نسل جلوگیری مینمایند.
عوامل اکتسابی مانند عفونتها
عوامل اکتسابی نظیر عفونتهای ویروسی، نارسایی زایمان (کمتر از ۲۸ هفته) یا هیپربیلیروبینمی، تا ۳۰ تا ۵۰ درصد موارد را پوشش میدهند و درمان کم شنوایی عصبی را با مداخله فوری در NICU ضروری میسازند. این عوامل، که در زایمانهای پرریسک شایعترند، درمان کم شنوایی عصبی را با نظارت اکسیژن و آنتیبیوتیکها مؤثرتر میکنند و از تبدیل به ناشنوایی دائمی جلوگیری مینمایند.

اگر به دنبال بهترین مرکز خرید سمعک در تهران هستید، همین امروز شنواطب را انتخاب کنید و از مشاوره تخصصی، تجهیزات پیشرفته و برندهای معتبر سمعک بهرهمند شوید!
روشهای سنتی درمان کم شنوایی عصبی
در درمان کم شنوایی عصبی، روشهای سنتی بر مدیریت علائم و بهبود کیفیت زندگی تمرکز دارند، زیرا هیچ درمان دارویی یا پزشکی قطعی برای ترمیم آسیب سیناپسی یا عصبی وجود ندارد. این رویکردها، که عمدتاً شامل ابزارهای کمکی و توانبخشی هستند، از دهههای گذشته استفاده میشوند و بر اساس راهنماهای بالینی مانند آنهایی که توسط انجمن شنوایی آمریکا (ASHA) و سازمان بهداشت جهانی (WHO) تأیید شدهاند، برای کودکان و بزرگسالان مناسب هستند.
با این حال، اثربخشی آنها در ANSD محدودتر از کمشنوایی حسی-عصبی معمولی است و اغلب نیاز به ترکیب با ارزیابیهای مکرر و رویکردهای بینرشتهای (مانند همکاری با گفتاردرمانان و متخصصان آموزش ناشنوایان) دارند. در سال ۲۰۲۵، این روشها همچنان پایهای برای درمانهای نوین مانند ژندرمانی محسوب میشوند.
استفاده از سمعک و وسایل کمکی
درمان کم شنوایی عصبی با سمعک و وسایل کمکی مانند سیستمهای FM، بر تقویت مستقیم سیگنالهای گفتاری تأکید دارد و این ابزارها را برای کودکان و بزرگسالان با ANSD ایدهآل میسازد. در کمشنوایی عصبی، این وسایل با کاهش نویز محیطی، درک گفتار را تسهیل میکنند و بر اساس راهنماهای ۲۰۲۵، در ۶۰ درصد موارد خفیف، گزینه اول محسوب میشوند.
سمعکهای FM و تقویت سیگنال
سمعکهای FM در درمان کم شنوایی عصبی، سیگنالهای گفتاری را از طریق فرکانس مدولهشده تقویت میکنند و درک گفتار را تا ۵۰ درصد در محیطهای نویزی بهبود میبخشد. این سیستمها، که میکروفون فرستنده را به گیرنده سمعک متصل میکنند، نویز پسزمینه را تا ۱۵ دسیبل کاهش میدهند و در درمان کم شنوایی عصبی، به ویژه برای کودکان در کلاس درس، مکالمات را واضحتر میسازند.
محدودیتها در ANSD
در موارد شدید ANSD، سمعک تنها حدود ۴۰ درصد مؤثر است و اغلب نیاز به ترکیب با آموزش شنوایی یا کاشت حلزون را ایجاد میکند. این محدودیتها، ناشی از اختلال سیناپسی عمیق، درمان کم شنوایی عصبی را به سمت گزینههای پیشرفتهتر سوق میدهد، اما در مراحل اولیه، سمعک همچنان برای حفظ مهارتهای زبانی ضروری است.

آموزش و توانبخشی شنوایی
در درمان کم شنوایی عصبی، آموزش و توانبخشی شنوایی نقش مکمل حیاتی ایفا میکند، که با تمرینهای منظم، مغز را برای پردازش بهتر سیگنالهای ناقص آموزش میدهد. این درمان کم شنوایی عصبی با برنامههای فردیسازیشده، پیشرفت زبان و گفتار را در ۷۰ درصد کودکان تسریع میکند و رویکردهای top-down را برای جبران bottom-up defects برجسته میسازد.
برنامههای auditory training
برنامههای auditory training برای کودکان در درمان کم شنوایی عصبی، مهارتهای زبانی را تا ۷۰ درصد تقویت میکند و بخشی کلیدی از توانبخشی است، با تمرکز بر تمایز صداها و کلمات. این تمرینها، که از اپلیکیشنهای تعاملی تا جلسات گروهی استفاده میکنند، درمان کم شنوایی عصبی را با بهبود neural plasticity، به ویژه در سنین پایین، مؤثرتر میسازند.
نقش گفتاردرمانی در بزرگسالان
در بزرگسالان، گفتاردرمانی در درمان کم شنوایی عصبی خستگی شنوایی را تا ۳۰ درصد کاهش میدهد و مکالمات روزمره را تسهیل میکند، با تمرینهای تمرکز بر lip-reading و contextual cues. این رویکرد، درمان کم شنوایی عصبی را با افزایش اعتمادبهنفس اجتماعی ترکیب میکند و بر اساس مطالعات ۲۰۲۵، کیفیت زندگی را در ۸۰ درصد موارد بهبود میبخشد.
برای یک تجربه شنوایی دقیق و مطمئن، اگر به دنبال تست شنواییسنجی در تهران هستید، همین امروز شنواطب را انتخاب کنید و سلامت شنوایی خود را به بهترین شکل ارزیابی کنید!
درمانهای نوین کمشنوایی عصبی در ۲۰۲۵
در سال ۲۰۲۵، درمان کمشنوایی عصبی (ANSD) با تمرکز بر بازسازی سلولی و ژنتیکی، مرزهای درمانی را جابهجا کرده است. ژندرمانی و سلولهای بنیادی، نرخ موفقیت را تا ۹۰٪ افزایش داده و امید به بازگشت شنوایی طبیعی را برای کودکان و بزرگسالان فراهم کردهاند.
ژندرمانی و داروهای بازسازیکننده
این روشها با هدف ترمیم نقصهای ژنتیکی و سیناپسی توسعه یافتهاند و برای موارد مرتبط با ژن OTOF ایدهآل هستند. تحویل ژنهای سالم از طریق وکتورهای AAV ایمنی بالا و نتایج سریع را تضمین میکند و در آزمایشهای ۲۰۲۵، بیش از ۹۰٪ کودکان تحت تأثیر مثبت قرار گرفتهاند.
ژندرمانی OTOF
ژندرمانی OTOF با تزریق ژن سالم به حلزون گوش، شنوایی را در بیش از ۹۰٪ نوزادان با کمشنوایی عصبی بازسازی کرده است. نتایج آزمایشهای Sensorion و UCI نشان میدهد بهبود سریع ظرف چند هفته اتفاق میافتد و در موارد DFNB9، درک گفتار تا ۸۰٪ افزایش یافته است.
داروی LY3056480
این دارو، توسعه یافته در دانشگاه UCL لندن، با تحریک مسیر Notch و ترمیم سیناپسهای عصبی، سلولهای مویی گوش را بازسازی میکند. آزمایشهای ۲۰۲۴ ایمنی آن را تأیید کردند و بهروزرسانیهای ۲۰۲۵، اثربخشی امیدوارکنندهای نشان میدهند. این دارو برای کمشنوایی عصبی خفیف تا متوسط یک گزینه بالقوه است.
سلولهای بنیادی و درمانهای بازساختی (Regenerative Therapy)
این روشها با هدف جایگزینی نورونها و سلولهای آسیبدیده، درمان کمشنوایی عصبی دائمی را ممکن میسازند. تزریق سلولهای pluripotent در مدلهای حیوانی تا ۶۰٪ بازسازی سلولهای شنوایی را بهبود بخشیده و اکنون به سمت آزمایشهای انسانی پیش میرود.
تزریق سلولهای بنیادی روده
سلولهای بنیادی روده (Intestinal Stem Cells) برای رشد سلولهای مویی گوش، در کلینیکهای ۲۰۲۵ تا ۶۰٪ بازسازی را در مدلهای حیوانی مانند zebrafish نشان دادهاند. این روش با بهرهگیری از ژنویرایش و اپیژنتیک، ریسک رد پیوند را کاهش داده و امید به کاربرد انسانی را افزایش میدهد.
آزمایشهای انسانی Sheffield
در ژوئیه ۲۰۲۵، دانشگاه Sheffield اولین آزمایش انسانی Regenerative Cell Therapy را با محصول Rincell-1 از Rinri Therapeutics انجام داد. این مطالعه بر بازسازی نورونهای شنوایی تمرکز دارد، ایمنی و تحویل سلولی را بررسی میکند و با هدف موفقیت اولیه ۷۰٪، چشمانداز جدیدی برای درمان کمشنوایی عصبی دائمی ارائه میدهد.

کاشت حلزون در درمان کمشنوایی عصبی (ANSD)
کاشت حلزون یکی از پیشرفتهترین روشهای درمانی برای افرادی است که به کمشنوایی عصبی (Auditory Neuropathy Spectrum Disorder) مبتلا هستند و سمعک برای آنها کارایی لازم را ندارد. در این روش، پزشک با دور زدن سلولهای مویی آسیبدیده در حلزون گوش و تحریک مستقیم عصب شنوایی، سیگنالهای الکتریکی را به مغز منتقل میکند تا فرد بتواند صدا را درک کند.
بر اساس جدیدترین دستاوردهای سال ۲۰۲۵، سیستمهای هوشمندی مانند Nexa از شرکت Cochlear با قابلیت بهروزرسانی نرمافزاری و تنظیم خودکار مبتنی بر هوش مصنوعی، باعث شدهاند نرخ موفقیت در کودکان تا ۹۰ درصد در درک واجها (فونمها) افزایش یابد. همچنین، استفاده از روشهای جراحی کمتهاجمی (Minimally Invasive) مدت زمان بهبودی را بهطور چشمگیری کاهش داده است.
مزایا و فرآیند کاشت حلزون
کاشت حلزون برای بیماران مبتلا به کمشنوایی عصبی، مزایای قابلتوجهی مانند بهبود هماهنگی عصبی، تقویت درک گفتار و رشد زبانی دارد.
فرآیند انجام این عمل معمولاً شامل مراحل زیر است:
- ارزیابی پیش از جراحی: انجام تستهای تخصصی مانند ABR و OAE برای اطمینان از سلامت عصب شنوایی
- جراحی: بهصورت سرپایی و در حدود دو ساعت تحت بیهوشی عمومی
- فعالسازی دستگاه: معمولاً ۳ تا ۴ هفته پس از عمل
در طول جراحی، برشی کوچک پشت گوش ایجاد میشود، الکترودها درون حلزون قرار میگیرند و پردازندهی داخلی زیر پوست نصب میشود.
مطالعات و متاآنالیزهای منتشرشده در سال ۲۰۲۵ نشان میدهد موفقیت کاشت حلزون در بیماران ANSD تقریباً برابر با بیماران مبتلا به کمشنوایی حسی-عصبی (SNHL) است و در موارد مناسب، تا ۹۹.۸ درصد موفقیت گزارش شده است.
بهبود شنوایی در کودکان ANSD
در کودکان، کاشت حلزون معمولاً درک گفتار را بین ۷۰ تا ۱۰۰ درصد افزایش میدهد و به رشد زبان و مهارتهای شنیداری کمک چشمگیری میکند، بهویژه زمانی که عمل قبل از ۶ سالگی انجام شود.
مطالعات اخیر نشان دادهاند که میانگین امتیاز فونمی در این کودکان به حدود ۹۰ درصد میرسد. همچنین کودکانی که زودتر کاشته میشوند، درک گفتار دقیقتر و عملکرد شنوایی طبیعیتری دارند.
ترکیب کاشت حلزون با توانبخشی شنوایی (Aural Rehabilitation)، به جلوگیری از تاخیر در گفتار و زبان کمک کرده و مسیر رشد طبیعی ارتباطی را برای کودک فراهم میسازد.
چالشهای جراحی در بزرگسالان
در بزرگسالان مبتلا به کمشنوایی عصبی، نرخ موفقیت کاشت حلزون حدود ۸۵ درصد است.
مهمترین چالش، زمانبر بودن توانبخشی پس از جراحی است، زیرا مغز باید خود را با سیگنالهای جدید الکتریکی سازگار کند. معمولاً دوره توانبخشی بین ۶ تا ۱۲ ماه طول میکشد و شامل جلسات گفتاردرمانی و تنظیمات دورهای دستگاه است.
در نهایت، بیش از ۸۰ درصد از بیماران بزرگسال پس از طی این دوره از نتایج شنوایی خود رضایت دارند و بسیاری از آنان حتی به سطوح تحصیلی و شغلی بالاتری دست پیدا میکنند. البته، عواملی مانند سن زمان کاشت، مدت کمشنوایی و وضعیت سلامت عمومی میتوانند بر میزان موفقیت نهایی تأثیر بگذارند.

مقایسه با روشهای غیرجراحی
در درمان کم شنوایی عصبی، کاشت حلزون در مقایسه با سمعک برتری قابل توجهی دارد، بهخصوص در موارد شدید ANSD. CI همگامسازی عصبی را بهبود میدهد و با نرخ موفقیت بالاتر، گزینهای پایدارتر برای بیماران است.
نرخ موفقیت کاشت حلزون vs سمعک
کاشت حلزون در ANSD حدود ۵۰ درصد بهتر از سمعک عمل میکند و درمان کم شنوایی را برای موارد شدید ایدهآل میکند. درک گفتار در محیطهای نویزی تا ۴۰ درصد افزایش مییابد، زیرا CI مستقیماً عصب را تحریک میکند، در حالی که سمعک تنها صدا را تقویت میکند.
هزینه و دسترسی در ایران
در ایران، کاشت حلزون با هزینه ۴۰۰-۵۰۰ میلیون تومان و گارانتی ۵ ساله ارائه میشود و تا ۹۰ درصد هزینهها توسط بیمههای پایه و تکمیلی پوشش داده میشود. این درمان کم شنوایی عصبی در مراکز معتبر تهران و شیراز در دسترس است و با حمایت دولتی، زمان انتظار برای خانوادهها کاهش یافته است.
| روش درمانی | توضیح مختصر | نرخ موفقیت تقریبی | مناسب برای | هزینه تقریبی (در ایران) |
|---|---|---|---|---|
| سمعک FM | تقویت سیگنالهای گفتاری با کاهش نویز؛ ایدهآل برای کلاس یا محیطهای شلوغ | ۴۰-۵۰% | کودکان و موارد خفیف | ۱۰-۵۰ میلیون تومان |
| Auditory Training | تمرینهای شنوایی برای تقویت زبان و پردازش مغز؛ جلسات منظم با اپ یا متخصص | ۶۰-۷۰% | کودکان و بزرگسالان | ۵-۲۰ میلیون تومان (دورهای) |
| ژندرمانی OTOF | تزریق ژن سالم به حلزون برای ترمیم سیناپس؛ انقلابی برای موارد ژنتیکی | ۷۰-۹۰% | نوزادان با جهش ژنتیکی | ۱۰۰-۳۰۰ میلیون تومان (تحت پوشش تحقیقاتی) |
| کاشت حلزون | تحریک مستقیم عصب شنوایی؛ بایپس سلولهای آسیبدیده | ۷۰-۸۵% | موارد شدید، کودکان و بزرگسالان | ۲۰۰-۵۰۰ میلیون تومان (با بیمه) |
| سلولهای بنیادی | تزریق برای بازسازی نورونها؛ هنوز در مرحله آزمایش انسانی | ۵۰-۷۰% (آزمایشی) | موارد دائمی و غیرقابل درمان | ۱۵۰-۴۰۰ میلیون تومان (آینده) |

قیمت سمعک در تهران را از هر جایی نپرسید!
شنواطب، مرجع تخصصی سمعک در تهران است.
پیشگیری و آینده درمان کمشنوایی عصبی (ANSD)
در درمان کمشنوایی عصبی (Auditory Neuropathy Spectrum Disorder – ANSD)، پیشگیری از طریق غربالگری زودهنگام و مدیریت عوامل خطر، همراه با پیشرفتهای تحقیقاتی تا سال ۲۰۲۵، نقش کلیدی در کاهش شیوع این اختلال ایفا میکند. بر اساس مطالعات اخیر، ترکیب رویکردهای پیشگیرانه با نوآوریهای ژنتیکی و هوش مصنوعی، نرخ موفقیت مداخلات را به طور قابل توجهی افزایش داده و از تبدیل اختلالات موقت به دائمی جلوگیری میکند. این پیشرفتها، به ویژه در ژندرمانی، نویدبخش آیندهای روشن برای میلیونها فرد مبتلا هستند.
راهکارهای پیشگیری از کمشنوایی عصبی
راهکارهای پیشگیری بر تشخیص زودهنگام و کنترل عوامل محیطی و ژنتیکی تمرکز دارند و میتوانند تا ۳۰-۵۰ درصد موارد ANSD را کاهش دهند، به ویژه در نوزادان پرخطر. غربالگری نوزادی و اتخاذ سبک زندگی سالم، بر اساس برنامههای جهانی سازمان بهداشت جهانی (WHO) تا ۲۰۲۵، دسترسی گستردهتری برای خانوادهها فراهم کرده و شیوع را در کشورهای در حال توسعه به طور چشمگیری پایین آورده است.
غربالگری نوزادان
غربالگری با استفاده از پاسخهای صوتی اوتوآکوستیک (OAE) در بدو تولد، همراه با تأیید پاسخهای شنوایی ساقه مغز (ABR)، امکان تشخیص زودهنگام بیش از ۸۰-۹۰ درصد موارد ANSD را فراهم میکند و مداخله فوری را تسهیل مینماید. این روشهای غیرتهاجمی، به ویژه ABR، حساسیت بالاتری برای شناسایی ANSD دارند و false positiveهای OAE را کاهش میدهند. مطالعات نشان میدهند که غربالگری universal با ABR، زمان تشخیص را از ماهها به روزهای اول زندگی کوتاه کرده و اثربخشی درمانهای اولیه مانند سمعک یا کاشت حلزون را تا ۷۰-۸۰ درصد افزایش میدهد، که منجر به بهبود قابل توجه در توسعه زبانی کودکان میشود.
سبک زندگی و اجتناب از عوامل خطر
اجتناب از داروهای اتوتوکسیک مانند آمینوگلیکوزیدها (مانند جنتامایسین) و نظارت بر سطوح دارویی، خطر ابتلا به ANSD را تا ۳۰-۴۰ درصد در بیماران پرخطر کاهش میدهد. جایگزینی این داروها با گزینههای ایمنتر یا کاهش دوزها، به ویژه در بزرگسالان تحت درمانهای شیمیدرمانی یا عفونتهای شدید، از آسیبهای عصبی دائمی جلوگیری میکند. علاوه بر این، کنترل عوامل محیطی مانند قرارگیری در معرض سر و صدای شدید و مدیریت بیماریهای زمینهای (مانند هیپربیلیروبینمی در نوزادان)، بخشی از استراتژیهای پیشگیرانه جهانی است.
چشمانداز تحقیقات ۲۰۲۵ و فراتر از آن
تحقیقات سال ۲۰۲۵ نشان میدهد که آینده درمان کمشنوایی عصبی (ANSD) در مسیر تحولی بزرگ قرار دارد. تمرکز پژوهشها بر هوش مصنوعی (AI) و ژندرمانی باعث شده تا چشمانداز درمانهای بازسازیکننده تا سال ۲۰۳۰ روشنتر از همیشه باشد.
این پیشرفتها توانستهاند نرخ موفقیت درمان را از حدود ۶۰ تا ۷۰ درصد به بیش از ۹۰ درصد در موارد ژنتیکی افزایش دهند و وابستگی بسیاری از بیماران به ابزارهایی مانند سمعک را به شکل قابل توجهی کاهش دهند.
پیشرفتهای AI در تشخیص
در سال ۲۰۲۵، استفاده از الگوریتمهای یادگیری عمیق (Deep Learning) تحولی اساسی در تشخیص کمشنوایی عصبی ایجاد کرده است.
این فناوریها قادرند نتایج تستهای شنوایی مانند ABR و OAE را با دقتی بالاتر از ۹۰ درصد تحلیل کنند و بر اساس الگوهای عصبی هر فرد، تشخیص شخصیسازیشدهای ارائه دهند.
به لطف هوش مصنوعی، فرآیند تشخیص که پیشتر ممکن بود هفتهها زمان ببرد، اکنون تنها در چند ساعت انجام میشود. این دقت بالا، بهویژه در کودکان، امکان تشخیص زودهنگام و شروع سریعتر درمان را فراهم کرده است.
مطالعات اخیر نشان میدهد که AI میتواند بینظمیهای عصبی را پیش از بروز علائم واضح شناسایی کند و به این ترتیب، مسیر درمان را هدفمندتر و مؤثرتر سازد.
امید به درمان کامل
در سال ۲۰۲۵، امید به درمان کامل ANSD با دو فناوری انقلابی تقویت شده است:
۱. ژندرمانی ژن OTOF
۲. بازسازی سلولی با سلولهای بنیادی زنده
در جدیدترین آزمایشهای بالینی شرکت Regeneron، بیش از ۹۰ درصد از کودکان دارای جهش ژن OTOF بهبود چشمگیری در شنوایی و درک گفتار نشان دادهاند — دستاوردی که متخصصان آن را یک «تغییر پارادایم در درمان کمشنوایی ژنتیکی» مینامند.
تا پایان سال ۲۰۲۵، چندین مطالعه در کشورهای مختلف مانند ایالات متحده، چین و کره جنوبی نتایج پایداری از این درمانها گزارش کردهاند.
پیشبینی میشود که تا سال ۲۰۳۰، درمانهای بازسازیکننده بتوانند شنوایی را بهطور کامل بازگردانند و رویکرد درمانی از «مدیریت علائم» به «بازسازی واقعی شنوایی» تغییر کند.
این نوآوریها نویدبخش آیندهای هستند که در آن هیچ فردی به دلیل مشکلات عصبی شنوایی از شنیدن محروم نخواهد بود — آیندهای که هدف آن دسترسی جهانی به درمانهای مؤثر و بازسازی کامل توان شنیداری است.

برای تجویز دقیق سمعک در مرکز تهران، هماکنون با مرکز شنوا طب تماس بگیرید و جلسه مشاوره تخصصی خود را رزرو کنید
سوالات متداول درباره درمان کم شنوایی عصبی (ANSD)
سوال ۱: درمان کم شنوایی عصبی چیست؟
سوال ۲: چه عواملی باعث کم شنوایی عصبی میشوند؟
سوال ۳: روشهای سنتی درمان کمشنوایی عصبی کداماند؟
سوال ۴: کاشت حلزون چه نقشی در درمان کم شنوایی عصبی دارد؟
سوال ۵: ژندرمانی و داروهای بازسازیکننده چگونه عمل میکنند؟
سوال ۶: سلولهای بنیادی چه کاربردی در درمان کم شنوایی عصبی دارند؟
سوال ۷: آیا پیشگیری در درمان کم شنوایی عصبی ممکن است؟

جمع بندی
در سال ۲۰۲۵، درمان کم شنوایی عصبی (ANSD) از محدوده روشهای سنتی مانند سمعک و کاشت حلزون فراتر رفته و به سمت بازسازی سلولی و ژنتیکی حرکت کرده است. ژندرمانی، سلولهای بنیادی و داروهای بازسازیکننده، نرخ موفقیت درمان کم شنوایی عصبی را تا ۹۰ درصد افزایش دادهاند و امکان بازگشت شنوایی طبیعی را برای کودکان و بزرگسالان فراهم کردهاند. کاشت حلزون همچنان در موارد شدید ANSD نقش حیاتی دارد و با فناوریهای نوین، بهبود درک گفتار و توسعه زبان را ممکن میسازد.
همچنین، پیشگیری با غربالگری زودهنگام و کنترل عوامل خطر محیطی، در درمان کم شنوایی عصبی تأثیر قابل توجهی دارد و میتواند از پیشرفت اختلال به ناشنوایی دائمی جلوگیری کند. چشمانداز تحقیقات ۲۰۲۵ و بعد، با بهرهگیری از AI و regenerative medicine، مسیر رسیدن به درمان کامل و شخصیسازیشده را هموار کرده است. در مجموع، درمان کم شنوایی عصبی امروز به یک حوزه جامع و چندبعدی تبدیل شده که ترکیبی از روشهای سنتی، نوین و پیشگیرانه را در بر میگیرد و امید به کیفیت شنوایی طبیعی را برای بیماران افزایش میدهد.